거리 지나다 보면 곳곳에 패인 도로나 무너진 담장 등을 복구하는 공사 현장들을 자주 마주치곤 합니다. 그런데 매일 우리 몸 속 DNA에서도 유전정보를 복구하는 공사가 이뤄진다는 것을 알고 있나요? DNA 손상 복구과정의 분자적 메커니즘을 연구하고 있는 기초과학연구원 유전체 항상성 연구단에서 지금 이 순간에도 여러분의 건강을 묵묵히 지키고 있는 고마운 친구, DNA 손상 복구에 대해 설명드립니다.
우리 몸을 만들어내는 유전정보는 DNA 안에 암호화되어 있습니다. 마치 바코드처럼 저장된 유전정보는 전사와 번역 과정을 통해 생명 활동에 필요한 핵산(RNA 등)과 단백질로 발현되고, 이 핵산과 단백질의 복잡한 작용이 인간과 같은 개체 단위 생명현상의 근간이 됩니다. 따라서 우리의 유전정보를 안전하게 유지하는 것은 매우 중요합니다.
그러나 우리의 유전정보는 매일 수많은 위협을 맞닥뜨립니다. 우리 몸의 세포들은(적어도 일부 세포는) 끊임없이 분열해야 하는데, 새로운 세포를 만들어내기 위해 필요한 DNA 복제 단계에서는 피할 수 없는 돌연변이가 생기곤 합니다. 우리 몸 안의 DNA 복제단백질들은 매우 높은 정확도로 일을 하지만 그 정확도가 100%는 아니니까요. 또한, 우리가 일상생활에서 접하는 다양한 물질, 특히 ‘발암물질’로 규정되는 물질들은 많은 경우 DNA에 직·간접적인 손상을 유발합니다. 이러한 손상은 DNA 상에 크고 작은 돌연변이들을 남기게 되고, 이 돌연변이의 축적은 암과 퇴행성 질환을 비롯한 다양한 질병의 원인이 됩니다.
그러나 다행히도 우리 세포 내에는 단세포 생물 때부터 진화시켜온 다양한 종류의 DNA 손상 복구 메커니즘이 있습니다. DNA 손상 종류에 따라 그에 맞는 복구과정을 알맞게 사용하는 덕에 우리의 유전정보는 비교적 오랜 기간 안전하게 유지되고, 인간이 오랜 세월을 살아갈 수 있는 기반이 됩니다. 비유하자면 DNA 손상과 DNA 손상 복구과정은 지금도 우리 몸 안에서 일어나는 끝없는 창과 방패의 싸움이라고 생각할 수 있습니다.
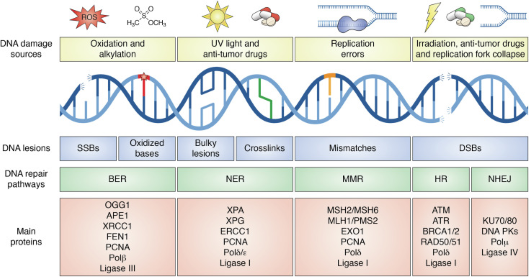
[그림 1] DNA 손상 복구 메커니즘
다양한 종류의 손상 복구 메커니즘이 존재하며, 각기 다른 DNA 손상(DNA lesion)에 따라 알맞은 복구과정을 사용한다.
(출처: Dall'Agnese, Giuseppe et al. “Role of condensates in modulating DNA repair pathways and its implication for chemoresistance.” The Journal of biological chemistry vol. 299,6 (2023): 104800. doi:10.1016/j.jbc.2023.104800)
DNA 두 가닥이 모두 끊어졌을 때
활성산소, 방사선 등의 강력한 DNA 손상 물질은 DNA 분자의 화학결합을 부술 수 있고, 이로 인해 DNA 이중 나선이 모두 잘리게 되는 것을 ‘DNA 이중나선 절단(DNA double-strand break)’ 이라 합니다. 한 세포 내에서 하루에 10~50개가량의 DNA 이중나선 절단이 일어나게 되는데, 다른 종류의 DNA 손상보다는 그 수가 적지만 적절히 복구되지 않을 경우 심각한 돌연변이나 세포 사멸 등의 결과를 낳을 수 있습니다.
DNA 이중나선 절단의 또 다른 무서운 점은, 절단된 DNA를 다시 이어 붙여도 점돌연변이(Point mutation)나 염색체가 재배열(chromosomal rearrangement)되는 등의 부작용들이 빈번하게 나타나기도 한다는 것입니다. 이 부작용들은 주로 DNA 이중나선 절단의 주된 복구 방식 중 하나인 ‘비상동성 말단 접합(nonhomologous end joining, NHEJ)’의 사용으로 나타납니다. DNA 이중나선 절단의 위험성이 큰 만큼, 미래의 유전체 안정성을 희생해 현재의 큰 문제를 해결한다고 볼 수 있습니다.
상동재조합(Homologous Recombination) 과정
상동재조합 과정은 분열 중인 세포에서 사용 가능한 DNA 양가닥 절단 손상 복구 방식입니다. 앞서 언급된 ‘비상동성 말단 접합’과는 달리, 세포 주기 중 합성기(S)를 지나면서 복제된 상동염색체의 온전한 유전정보를 복사해 가져오는 방식으로 복구를 진행하므로 손상 복구과정에서 돌연변이를 유발하지 않는 안전한 손상 복구과정으로 알려져 있습니다.
상동재조합 과정은 다양한 손상 복구 단백질이 차례로 관여하는 정교한 분자적 메커니즘을 요구합니다. 먼저, 말단 절제(end resection) 과정은 DNA 손상 위치 주변에 붙은 단백질이나 복잡한 구조를 제거하며 DNA 이중 가닥을 단일 가닥으로 절제해 냅니다. 단일 가닥으로 노출된 DNA는 상동 염색체 상응하는 정상의 DNA 염기 서열로 침투하여, 그 상보적 염기 서열을 주형으로 DNA를 합성해 손상됐던 유전 정보를 다시 복구합니다.
상동재조합과 같은 DNA 손상 복구과정은 복잡한 분자적 메커니즘이 정해진 순서대로 진행되어야 하기 때문에, 복구 중에 문제가 생긴다면 오히려 더 큰 유전체 불안정성을 유발할 수 있습니다.
상동재조합 과정에서 새로운 현상 발견
상동재조합 과정의 초기단계인 말단 절제 과정에도 역시 다양한 종류의 손상 복구 단백질이 참여합니다. 저희 연구진은 DNA 복제 과정에 관여하는 고리 형태의 PCNA 단백질이 말단 절제 과정에 관여함을 밝혀냈습니다. MRN(MRE11-RAD50-NBS1) 단백질 복합체의 작용으로 말단 절제 과정이 시작되면 PCNA가 DNA 이중나선 절단 위치로 이동하고, 암 억제 단백질로 알려진 ATAD5 단백질이 PCNA를 다시 말단 절제 지점으로부터 떨어뜨리는 것을 확인했습니다. 말단 절제 과정에 끼어들게 된 PCNA는 MRN 복합체의 작동을 저해했고, 특히 ATAD5 단백질의 결핍으로 PCNA가 말단 절제 지점에 계속 남으면 말단 절제 과정뿐만 아니라 상동재조합 과정 전반이 저해됨을 확인했습니다. 상동재조합 복구가 어려운 상황에서 세포는 오류를 유발하는 복구 시스템(Polymerase Theta mediated end joining, TMEJ)을 대안으로 선택해 생존을 이어갈 수 있지만 그 결과로 돌연변이가 증가하게 됩니다.
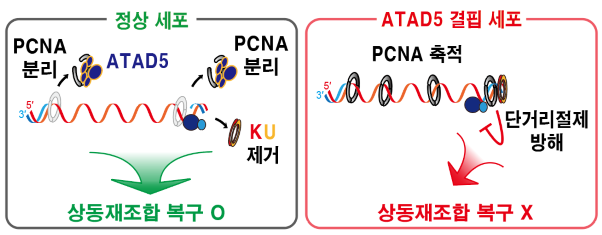
[그림 2] DNA 이중나선 절단 부위에 쌓인 PCNA가 상동재조합 복구 결함을 일으키는 메커니즘
정상 세포(왼쪽 그림)에서는 이중나선 절단 위치로 이동한 PCNA가 ATAD5 단백질에 의해 분리되고, 이후 말단 결합 단백질 KU70/80 제거를 포함한 후속 상동재조합 과정이 진행된다. ATAD5 결핍 세포(오른쪽 그림)에서는 이중나선 절단 부위에 PCNA가 남아있게 되고, 단거리 말단절제를 방해하여 후속 상동재조합 복구과정을 저해한다.
DNA 손상 복구과정에 대한 이해를 높이는 것은 암이나 유전병 치료 기술의 근간이 됩니다. 저희 연구진이 규명한 상동재조합 과정 속 ATAD5 단백질의 중요성을 바탕으로 상동재조합 과정에 대한 이해를 높여, 향후 임상에서 사용 가능한 치료법의 분자적 메커니즘으로 활용할 수 있기를 기대합니다.
논문명: Short-range end resection requires ATAD5-mediated PCNA unloading for faithful homologous recombination, Nucleic Acid Research, 2023
안정적인 DNA 손상 복구는 언제나 도움이 될까?
DNA 손상 복구과정은 생명체의 유전체 안정성을 유지하는 수호자로 비유되곤 합니다. 안정적인DNA 손상 복구는 해당 개체의 생명과 세대를 넘는 유전정보의 안전을 보장하죠. 그러나 안정적인 DNA 손상 복구가 도리어 해가 되는 경우도 있습니다. 바로 ‘암’이 발병한 경우입니다.
암의 종류마다 차이가 있지만, 암세포가 안정적인 DNA 손상 복구 시스템을 갖고 있는 경우에는 그렇지 못한 암세포와 비교해 항암 반응성이 좋지 않고 환자의 예후가 나쁜 경우로 이어지기도 합니다. 전통적인 항암치료제는 암세포의 DNA에 직접적인 손상을 가하는 경우가 많은데, DNA 손상 복구과정이 안정적인 암세포는 항암 치료제에 쉽게 저항성을 갖게 되는 것이죠.
최근 일련의 연구에서는 암세포에서 많이 나타나는 바르부르크 효과*(Warburg effect)로 인한 젖산의 축적이 암세포 내에서의 상동재조합 과정을 촉진시키고, 높은 젖산 수준에 기인한 높은 상동재조합 활성은 암 환자의 좋지 않은 예후로 이어질 수 있다는 사실을 밝혔습니다. 반대로 젖산에 의해 상동재조합 중요 단백질(MRN 단백질 복합체)의 락틸화(Lactylation)를 방해함으로써 상동재조합을 저해하고, 항암 치료제에 대한 높은 반응성을 이끌어냈습니다.
* 바르부르크 효과(Warburg effect): 산소가 존재하는 호기성 조건에서 암세포가 미토콘드리아를 통한 산화적 인산화(oxidative phosphorylation)를 거쳐 에너지 산물인 ATP를 생산하기보다 포도당을 산소없이 피루브산(pyruvate)으로 변화시키는 과정을 선호하는 현상을 말한다. 피루브산은 발효를 거쳐 부산물인 젖산으로 전환된다.
참고문헌:
- NBS1 lactylation is required for efficient DNA repair and chemotherapy resistance, Nature, 2024
- Metabolic regulation of homologous recombination repair by MRE11 lactylation, Cell, 2024
이처럼, DNA 손상 복구과정은 우리에게 매우 중요한 과정이지만, 때로는 그 과정을 저해하거나 약점을 파고드는 것이 질병 치료의 중요한 시발점이 되기도 합니다. 지금 이 순간에도 많은 연구자들이 DNA 손상 복구과정에 담긴 비밀을 밝히기 위해 열심히 연구하고 있습니다. DNA 손상 복구에 대한 높은 이해를 바탕으로 더 많은 질병을 정복할 수 있는 날이 오기를 기대해 봅니다.

본 콘텐츠는 IBS 공식 포스트에 게재되며, https://post.naver.com/ 에서 확인하실 수 있습니다.






