 뉴스센터
뉴스센터
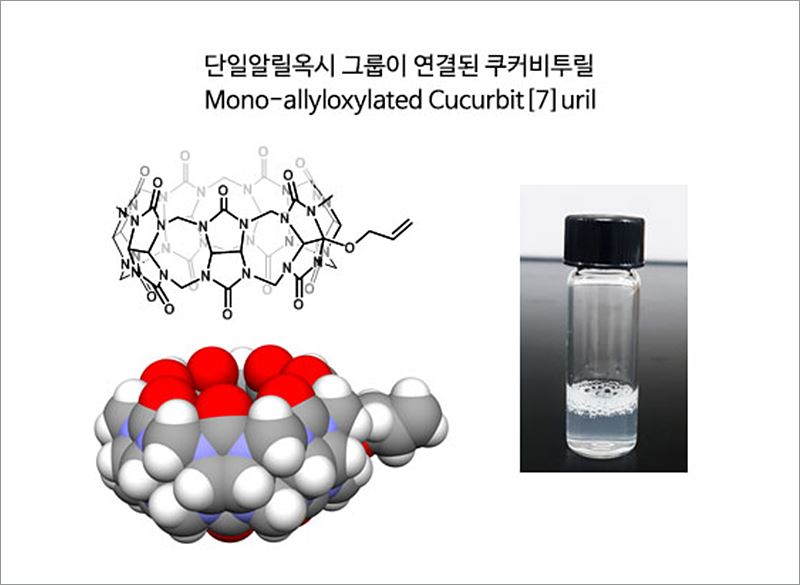
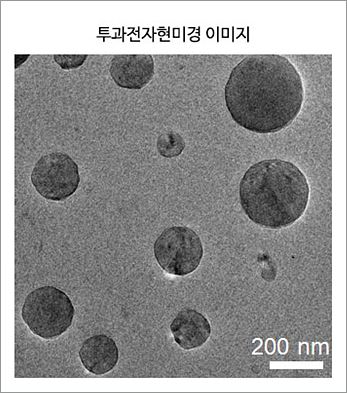
근적외선 레이저로 항암제 전달 조절하는 나노 소포체 개발- 쿠커비투릴 유도체로 만든 전달체, 레이저로 항암제 방출 조절 성공 - 항암제가 강력한 항암 효과도 있지만, 부작용도 만만치 않다는 사실을 흔히 알고 있을 것이다. 항암제 투여 시 암 세포뿐만 아니라 정상 세포에도 약물이 유입되기 때문이다. 정상 세포에는 유입되더라도 항암제를 머금고 있다가 암 세포에서만 항암제를 ‘대방출’ 하는 마법같은 주머니가 있다면 얼마나 좋을까? 속이 빈 호박 모양의 분자 쿠커비투릴이라면 항암제를 암세포에 전달하는 좋은 주머니가 될 것이라고 생각한 연구팀이 있다. 바로 IBS 복잡계 자기조립 연구단의 김기문 단장, 박경민 연구위원 연구팀이다. 이들은 쿠커비투릴 유도체(Mono-allyloxylated Cucurbit[7]uril)가 수용액 상에서 물과 섞이지 않고 작은 주머니 형태의 소포체를 형성하는 성질에 착안, 소포체 내부의 빈 공간에 항암제를 넣어 항암제 전달체로 만드는 데 성공했다. 쿠커비투릴 유도체는 어떻게 수용액에서 소포체를 형성할 수 있을까? 일반적으로 자연계에서 소포체 형성은 친수성의 머리 부분과 소수성의 꼬리부분으로 이루어진 인지질 분자의 자기조립을 통해 형성된다고 알려져 있다. 그러나 이번 연구에서 연구진이 고안한 쿠커비투릴 유도체의 경우, 소수성 꼬리가 짧음에도 소포체 형태를 이루는 흥미로운 성질을 보인다. 쿠커비투릴 유도체를 물에 넣으면 마치 비누에서 볼 수 있는 거품이 일어나는데, 자기조립으로 소포체를 형성하는 초분자이기 때문에 보이는 현상이다.
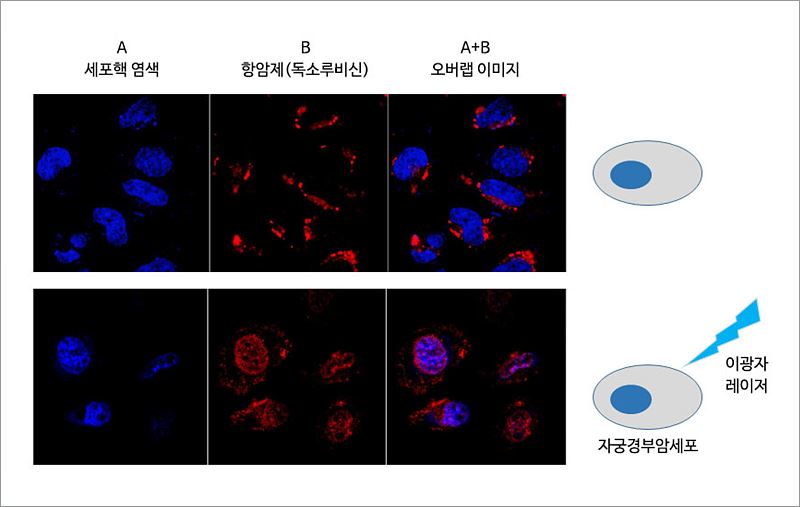
쿠커비투릴 유도체로 항암제 전달체를 만들었는데, 여기서 끝이 아니다. 항암제를 담는 데 쓰인 쿠커비투릴 유도체는 빛에 민감한 성질 또한 갖고 있어, 이것으로 만든 나노 소포체에 근적외선 레이저를 조사하면 항암제 방출을 유도할 수 있다. 연구진은 레이저에 노출된 쿠커비투릴 유도체가 세포 내 다른 물질과 결합해 소포체 구조가 해체되면서 내부에 담고 있던 항암제를 방출하는 원리임을 밝혔다. 연구진은 항생제 일종인 독소루비신(Doxorubicin)을 담고 있는 나노 소포체 수용액을 암세포에 처리하면 세포가 이들을 흡수함을 확인했다. 암세포에 근적외선 레이저를 조사한 결과, 세포 내부로 흡수된 나노 소포체들은 레이저에 반응해 해체되고 내부에 있던 항생제가 방출됐다. 이렇게 방출된 항생제는 세포핵까지 침투해 결국 암세포는 사멸함을 확인했다.
나노 소포체에 사용한 근적외선은 2개의 광자가 하나의 광자처럼 기능하는 이광자 레이저로, 가시광선 레이저에 비해 투과력이 높으면서 일반 단백질에 대한 변성률이 낮아 부작용이 적은 것이 강점이다. 때문에 근적외선에 반응하도록 고안한 나노 소포체는 항암 치료에 적합한 나노 재료라 할 수 있다. 더 나아가 근적외선 레이저의 조사 시간과 강도에 따라 암세포 사멸 정도는 달라졌다. 레이저를 더 긴 시간 동안 강한 세기로 조사할수록 암세포가 사멸하는 속도 또한 빨라졌다. 레이저로 항암제 방출 정도를 자유롭게 조절할 수 있음은 물론 항암제 전달체로서의 활용성 또한 증명한 셈이다. 김기문 단장과 박경민 연구위원은 “이번 연구에서 고안한 광민감성 쿠커비투릴 유도체는 향후 화학 항암제를 적용하는 암 치료의 발전에 기여할 것” 이라 말했다. 이번 연구에서 개발한 나노 소포체는 항암제를 선택적으로 적용 가능케 한다는 점에서 항암 치료 효과를 극대화하는 나노 재료로 활용될 것으로 기대된다. 이번 연구결과는 독일 응용화학회지(Angewandte Chemie International Edition, IF 11.994) 온라인판에 독일시간으로 지난 1월 29일에 게재됐다.
IBS 커뮤니케이션팀 |
|||
Center for Self-assembly and Complexity (복잡계 자기조립 연구단)Publication Repository |
|||
|
|
| 다음 | |
|---|---|
| 이전 |
- 콘텐츠담당자
- :
- 최종수정일 2023-11-28 14:20