 뉴스센터
뉴스센터
교모세포종의 항암제 내성 극복할 단서 찾았다!- iBS·UNIST 연구진, 세포주 427개 전장 유전체 분석해 표적 유전자 발굴 - - 노화와 항암제 내성에 관여하는 특정 효소의 작용도 밝혀.. NAR 논문 게재 - 기초과학연구원(IBS)과 UNIST 연구진이 교모세포종의 항암제 내성을 무력화시킬 수 있는 단서를 찾았다. 교모세포종은 환자 열 명 중 아홉 명이 5년 내 사망하는 악성 뇌종양으로, 현재 이 교모세포종을 직접 공격할 수 있는 항암제는 테모졸로마이드 (TMZ) 하나뿐이다. UNST(총장 박종래) 의과학대학원 안톤 가트너 특훈(Anton Gartner) 교수(IBS 유전체 항상성 연구단 학연 연구위원) 팀은 바이오메디컬공학과 이세민 교수팀, IBS 유전체 항상성 연구단과의 공동 연구를 통해 APE1 등이 교모세포종의 항암제 내성을 극복할 수 있는 유망한 표적 유전자라는 연구 결과를 내놨다. 해당 표적 유전자에 암호화된 단백질을 억제하는 약물과 TMZ를 병용하면 치료 효과를 높일 수 있을 것으로 기대된다. TMZ를 비롯한 세포독성 항암제는 세포 DNA에 손상을 유발하는 방식으로 작용하는데, 암세포는 이에 대응해 DNA 손상을 스스로 복구하는 등 항암 치료를 어렵게 한다. 연구팀은 이 같은 DNA 복구1) 경로와 세포의 TMZ 내성 간의 상관 관계를 알아내기 위해 19개의 DNA 손상 복구 경로에 관여하는 47개 단백질 유전자를 한 개 이상 불활성화 시킨 세포주를 제작한 뒤, 이들의 TMZ 민감성을 분석했다.실험결과, 세포의 APE1 단백질 발현을 억제하면, MMR 유전자가 결핍된 TMZ 내성 세포라도 항암제 민감성이 개선됐다. MMR 유전자 결핍은 TMZ 내성 원인 중 하나다. 반면 MPG 단백질 발현 억제는 항암제 민감성에 영향을 미치지 않았다. APE1 단백질, MPG 단백질 모두 BER 복구 경로에 참여하는 단백질이지만 상반된 효과를 보인 것이다. 연구팀은 MPG 단백질 발현을 억제해도 항암제 내성이 개선되지 않은 이유를 세포가 TLS라는 대체 복구 경로를 사용하기 때문이라고 분석했다. TLS 경로에 관여하는 단백질 유전자도 항암제 내성 억제의 표적이 될 수 있으며, 이 부분에 관한 추가 연구를 진행할 계획이라고 설명했다. 이번 연구를 통해 항암제 내성과 노화 간의 관계도 새롭게 드러났다. 노화로 축적된다고 알려진 DNA 돌연변이 패턴2)이 TMZ에 대응하는 과정에서 세포에 축적된 DNA 돌연변이 패턴과 유사했다. 이는 TLS 중합 효소의 하나인 TLS 중합 효소 제타가 노화와 TMZ 내성 세포 모두에서 돌연변이를 축적하는 원인임을 시사하는 대목이다. 공동연구팀은 “DNA 복구 과정의 취약성을 표적으로 하는 항암, 노화 예방과 같은 정밀 의학 연구에 중요한 단서를 제공했다는 점에서 의미가 있다”라고 말했다. 이번 연구는 IBS 유전체 항상성 연구단의 드미트리 이바노프(Dmitry Ivanov) 연구위원이 공동 교신저자로, UNIST 바이오메디컬공학과 황태주 연구원이 제1저자로 참여했다. 연구 결과는 국제학술지 핵산 연구(Nucleic Acids Research)에 12월 5일 자로 게재됐으며, 연구수행은 한국연구재단, 기초과학연구원 등의 지원을 받아 이뤄졌다. (논문명: Comprehensive whole-genome sequencing reveals origins of mutational signatures associated with aging, mismatch repair deficiency and temozolomide chemotherapy) 그림 설명
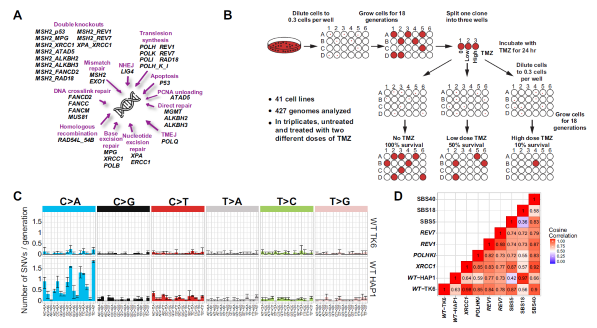
그림1. 실험 설계도. DNA 복구 경로와 관련된 단백질 유전자를 하나 이상 결핍시킨 세포주를 제작하고, 이를 세포주를 무처리, 저농도 TMZ 처리, 고농도 TMZ를 하여, 전장 유전체 분석을 실시함.
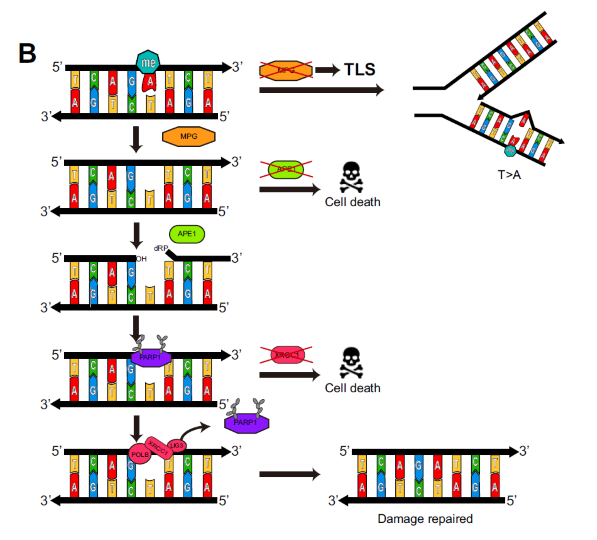
그림2 BER 복구 비활성화를 통한 테모졸로마이드 약물 내성 극복 기전. BER 복구에 참여하는 APE1 단백질 유전자와 XRCC1 단백질 유전자 발현을 억제하면 항암제 민감성을 회복한다. 반면 MPG 단백질 유전자 발현 억제는 영향을 미치지 않았다.
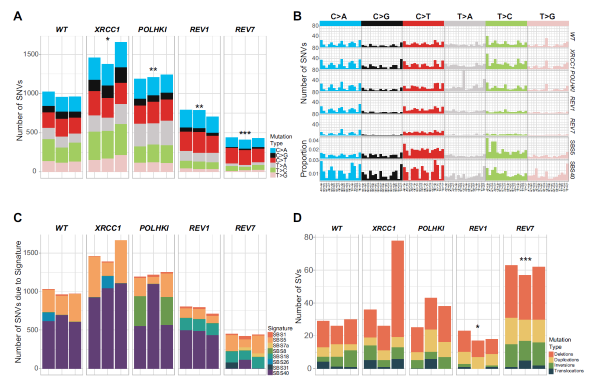
그림3. 노화 관련 돌연변이 패턴(signature)의 원인이 중합 효소 제타(zeta)임을 보여주는 분석 결과
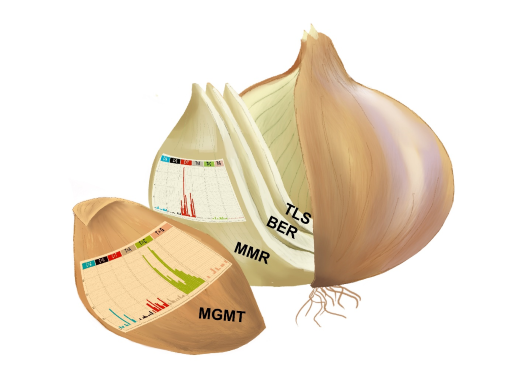
그림4. 연구 방법론을 형상화한 그림. 다양한 DNA 손상 복구 기전을 양파 껍질 까듯 순차적으로 차단하는 방식을 통해 항암제 내성이 남긴 돌연변이 패턴을 분석했음을 설명한다. 양파 잎에 그려진 그래프는 돌연변이 패턴을 분석 결과다. 1) DNA 복구(DNA Repair) : 세포 유전체를 구성하는 DNA의 손상을 확인하고 이를 교정하는 과정을 말한다. 세포에는 다양한 DNA 복구 경로가 있다. 2) 돌연변이 패턴 (Mutation Signature) : DNA에 발생한 손상과 이를 복구 하는 과정에서 DNA에 발생하는 염기서열 변이 등을 말한다. 인간 DNA에는 약 32억개의 염기들의 배열이 있으며, 각 염기가 정해진 염기와 짝을 이루고 있다. |
| 다음 | |
|---|---|
| 이전 |
- 콘텐츠담당자
- :
- 최종수정일 2023-11-28 14:20